|
Barato Natural
Produzidos pelo cérebro, os endocanabinóides são semelhantes ao princípio
ativo
Uso Ancestral A maconha e seus derivados, como o haxixe e o skank, estão entre as drogas psicoativas mais consumidas no mundo. Os antigos chineses já conheciam seus efeitos no alívio das dores e dos distúrbios mentais, embora o principal uso fosse na manufatura de tecidos. As resistentes fibras da cânabis, também conhecida como cânhamo, foram empregadas por gregos e romanos na produção de cordas e velas para suas embarcações. Em outras culturas, porém, foram as propriedades inebriantes da maconha que tiveram destaque. Na Índia, era usada em rituais religiosos. Durante a Idade Média, era comum seu consumo em terras árabes. No Iraque do século XV, os epiléticos era tratados com a planta. Os europeus começaram a usá-la para finalidades recreacionais só depois que viram o exemplo dos egípcios quando as terras destes foram ocupadas por Napoleão em 1799. Nas Américas, a maconha foi introduzida pelos escravos negros no século XVII. Até o início do século XX, o produto era facilmente encontrado nas farmácias brasileiras sob a forma de cigarros, indicado por médicos para um amplo leque de males, como dor de cabeça e úlceras. Nos Estados Unidos, a droga tornou-se muito popular entre músicos de jazz na década de 20. Milhões de pessoas fumam ou ingerem a maconha por seus efeitos no sistema nervoso, freqüentemente descritos como semelhantes aos percebidos após a ingestão de bebidas alcoólicas. Estima-se que aproximadamente 30% da população americana com mais de 12 anos de idade já tenha experimentado a droga e cerca de 5% sejam usuários. Doses altas podem causar alucinações em alguns indivíduos, embora a maioria deles sinta apenas sonolência. Está comprovado que a maconha compromete a memória de curto prazo, a cognição e a coordenação motora. Essas deficiências, no entanto, parecem ser revertidas depois que ela é eliminada do organismo. Fumar maconha oferece riscos semelhantes aos do tabagismo. Por outro lado, alguns benefícios medicinais são evidentes, como o alívio de dores e da ansiedade. Além disso, ela inibe o vômito e abre o apetite - características úteis para pacientes que sofreram perda aguda de peso, geralmente conseqüência de tratamentos quimioterápicos. Em 1964, Raphael Mechoulam, da Universidade Hebraica, em Jerusalém, isolou o delta-9-tetrahidrocanabinol (THC) como composto responsável por praticamente toda a atividade farmacológica da maconha. O passo seguinte foi identificar o receptor por meio do qual o THC exerce seus efeitos. O receptor canabinóide conhecido como CB1 foi descoberto em 1988, quando Allyn C. Howlett, da Universidade de St. Louis, "colou" uma etiqueta radiotiva numa molécula derivada do THC e observou seu percurso dentro do cérebro de ratos. Com base nessa descoberta, Miles Herkenham e Lisa Matsuda, dos Institutos Nacionais de Saúde, em Bethesda, clonaram o receptor CB1. Sua importância na ação do THC foi comprovada pelos trabalhos independentes de dois cientistas: Catherine Ledent, da Universidade Livre, de Bruxelas, e Andreas Zimmer, do Laboratório de Neurobiologia Molecular da Universidade de Bonn. Eles criaram camundongos geneticamente modificados para não expressar esse receptor. Como esperado, o THC administrado a esses animais não produziu nenhum efeito. Mais tarde, outro receptor canabinóide foi identificado, o CB2. Presente apenas na medula espinhal e no sistema nervoso periférico, ele parece estar envolvido na resposta imunológica. De forma geral, os receptores farmacológicos podem ser de dois tipos. Os chamados ionotrópicos são canais iônicos seletivos a alguns íons, como cálcio ou sódio. O segundo tipo, conhecido como metabotrópicos, tem seu mecanismo de ação acoplado à ativação de uma proteína específica, a proteína-G. Os cientistas descobriram que o receptor CB1 é um dos mais abundantes receptores associados à proteína-G existentes no sistema nervoso central. Ele está presente em maior densidade no córtex cerebral, hipocampo, hipotálamo, cerebelo, gânglios da base, tronco encefálico, medula espinhal e amígdala. Essa distribuição sugere parte dos efeitos da maconha. A experiência mental vem de sua ação no córtex; os prejuízos de memória resultam de sua atividade no hipocampo. A disfunção motora está relacionada ao efeito nos gânglios da base. Na medula espinhal, o THC reduz as dores; no tronco encefálico, controla o reflexo do vômito. O hipotálamo regula também o apetite e a amígdala, as reações emocionais. Os efeitos da maconha são tão amplos justamente porque ela parece agir em toda parte.
Lição do ópio Com o tempo, mais detalhes foram surgindo sobre a localização neuronal do receptor CB1. Experimentos feitos por Tamás F. Freund, do Instituto de Medicina Experimental da Academia Húngara de Ciências, em Budapeste, e por Kenneth P. Mackie, da Universidade de Washington, revelaram que o receptor canabinóide está apenas em certos neurônios e em regiões muito específicas deles. O CB1 está mais densamente presente em neurônios que usam GABA (ácido gama-aminobutírico) - o principal neurotransmissor inibitório do sistema nervoso. Geralmente situado próximo à sinapse, o CB1 parece estar de alguma forma envolvido na transmissão gabaérgica. Por que nosso cérebro gastaria energia para produzir um receptor específico para uma substância sintetizada por uma planta? A mesma pergunta já havia surgido na década de 70 em relação à morfina, o princípio ativo da papoula o qual, como se descobriu mais tarde, liga-se aos chamados receptores opióides. Foi assim que os cientistas descobriram que as pessoas produzem seu próprio ópio - as endorfinas e as encefalinas. Parecia provável, portanto, que algo similar estivesse acontecendo com o THC e o receptor canabinóide. Em 1992, 28 anos depois de ter identificado o THC, Mechoulam isolou um ácido graxo curto produzido no cérebro e que se liga ao CB1, imitando todos os efeitos do THC. A molécula foi denominada anandamida, inspirada na palavra "ananda", que em sânscrito significa felicidade, bem-aventurança. Anos depois, Daniele Piomelli e Nephi Stella, da Universidade da Califórnia em Irvine, identificaram outro lipídio, o 2-aracdonil-glicerol (2-AG), ainda mais abundante que o primeiro em certas regiões do sistema nervoso central. Hoje as duas moléculas são consideradas os principais canabinóides endógenos, ou endocanabinóides. (Recentemente, outros foram identificados, mas seus papéis ainda não estão claros.) Ao que parece, os endocanabinóides e seus respectivos receptores evoluíram juntos como parte de um sistema de comunicação neural. Por acaso, o THC é semelhante o suficiente para ativar os receptores canabinóides. Neurotransmissores convencionais geralmente são solúveis em água e armazenados em altas concentrações em pequenas vesículas. Quando um neurônio dispara, as vesículas se fundem à membrana celular e os liberam na fenda sináptica, onde vão encontrar receptores na superfície do neurônio pós-sináptico. Os endocanabinóides, porém, não são armazenados em vesículas. Eles são lipídios rapidamente sintetizados com base em componentes da membrana celular. Sua liberação na fenda sináptica depende da elevação da concentração de íons cálcio no interior da célula ou da ativação de receptores acoplados à proteína G.
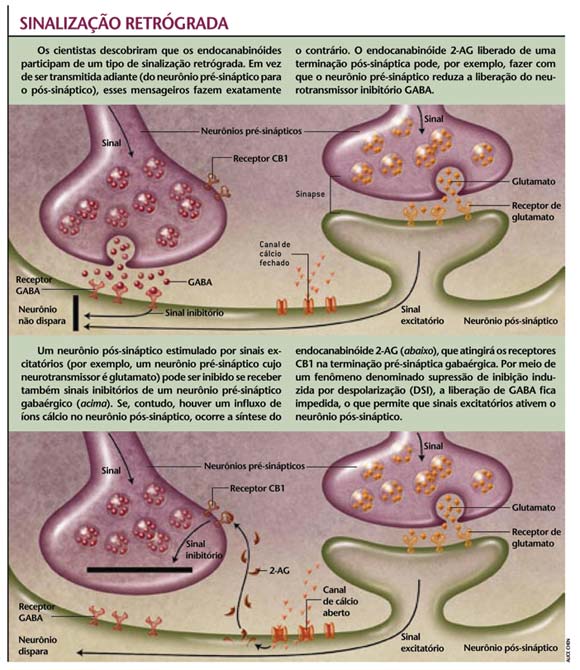
De trás para frente Por se tratar de neurotransmissores incomuns, o papel dos endocanabinóides na fisiologia cerebral permaneceu um completo mistério durante anos. No início dos anos 90, porém, as respostas começaram a surgir, ainda que indiretamente. Um de nós (Alger) descobriu algo diferente enquanto estudava neurônios piramidais - as principais células do hipocampo. O aumento da concentração de íons cálcio dentro dessas células, ainda que por um curto período, diminuía a inibição gabaérgica que chegava até elas. Alain Marty, hoje no Laboratório de Fisiologia Cerebral da Universidade René Descartes, em Paris, observou o mesmo efeito em neurônios do cerebelo. Esses resultados curiosos sugeriam uma sinalização retrógrada, isto é, do neurônio pós-sináptico para o pré-sináptico - o contrário, portanto, do que se espera da transmissão nervosa. O fenômeno foi chamado inibição da supressão induzida por despolarização (DSI, na sigla em inglês). Tudo levava a crer que um novo sistema de comunicação neuronal estava por ser descoberto. Restava saber, no entanto, qual era o mensageiro que trafegava de trás para frente e de alguma forma desligava a inibição gabaérgica. O que se sabia até aquele momento era que esse tipo de sinalização retrógrada ocorria apenas durante o desenvolvimento do sistema nervoso. Encontrá-la também entre neurônios adultos foi uma descoberta impressionante. Contudo, a identidade desse misterioso mensageiro permaneceu oculta por mais alguns anos, durante os quais várias moléculas candidatas foram propostas. Em 2001, um de nós (Nicoll) e Rachel I. Wilson, da Universidade da Califórnia em São Francisco, mostraram que um endocanabinóide, provavelmente o 2-AG, ajustava-se perfeitamente ao papel de mensageiro retrógrado. Curiosamente, um grupo liderado por Masanobu Kano, da Universidade Kanazawa, Japão, anunciou a mesma descoberta simultaneamente. As duas equipes demonstraram que uma droga bloqueadora de receptores canabinóides em células pré-sinápticas impedia a DSI; inversamente, drogas estimuladoras do receptor CB1 induziam o fenômeno. Pouco depois, outros cientistas demonstraram que neurônios de camundongos desprovidos de receptores canabinóides são incapazes de gerar DSI. Começava a fazer sentido o fato de sua localização estar restrita às terminações pré-sinápticas garbaérgicas - só assim eles poderiam detectar endocanabinóides liberados por neurônios pós-sinápticos próximos, e responder a eles. Com o passar do tempo, a DSI foi reconhecida como um aspecto importante da atividade cerebral. A atenuação temporária da inibição intensifica a potenciação de longo prazo - processo de aprendizagem pelo qual a informação é armazenada por meio do fortalecimento das sinapses. Essa transferência e armazenamento de informações costuma envolver pequenos grupos de neurônios, aparentemente mais adequados para a ação dos endocanabinóides. Como moléculas lipossolúveis, eles não alcançam grandes distâncias no ambiente extracelular - que é aquoso. Além disso, mecanismos de absorção e de degradação garantem sua ação em um espaço confinado durante curto período. Como efeito local de curta duração, a DSI permite que neurônios individuais se desconectem brevemente de seus vizinhos e codifiquem informações. Uma série de descobertas preencheu outras lacunas na compreensão da função celular dos endocanabinóides. Quando eles se ligam ao receptor CB1 podem, em alguns casos, impedir células pré-sinápticas de liberar neurotransmissores excitatórios. Wade G. Regehr, da Universidade Harvard, e Anatol C. Kreitzer, hoje na Universidade Stanford, descobriram que, no cerebelo, os endocanabinóides presentes nos terminais excitatórios ajudam na regulação do enorme número de sinapses envolvidas no controle da coordenação motora e da integração sensorial. Isso explica, pelo menos em parte, os leves distúrbios motores e sensoriais freqüentemente associados ao hábito de fumar maconha. Pesquisas recentes começaram a relacionar com maior precisão a ação neural dos endocanabinóides a seus efeitos fisiológicos e comportamentais. Investigando as bases da ansiedade, os cientistas treinaram roedores na associação de determinado sinal sonoro à sensação de medo. Nesse tipo de experimento costuma-se administrar um choque elétrico breve e de baixa intensidade nas patas dos animais ao mesmo tempo que um som é gerado. Ao ouvi-lo de novo depois de algum tempo, eles antecipam o choque com uma reação de congelamento dos movimentos. Mas, quando o estímulo sonoro é repetido várias vezes sem vir acompanhado do choque, os animais deixam de temê-lo, isto é, o condicionamento desaparece - processo denominado extinção. Em 2003, Giovanni Marsicano, do Instituto de Psiquiatria MaxPlanck, em Munique, demonstrou que camundongos desprovidos de CB1 rapidamente aprendiam a temer o som relacionado ao choque; mas, ao contrário dos que tinham os receptores intactos, não perdiam o medo do estímulo sonoro quando ele não estava mais associado à descarga elétrica. Os resultados indicam que os endocanabinóides desempenham papel importante na extinção de sentimentos ruins e de dor deflagradas pela lembrança de experiências passadas. Tais descobertas levantam a possibilidade de que números anormalmente baixos de receptores canabinóides ou a liberação imperfeita desses mensageiros estejam associados à síndrome de stress pós-traumático, às fobias e a certas formas de dor crônica. A idéia é coerente com o fato de algumas pessoas fumarem maconha para diminuir a ansiedade. É também concebível, embora não esteja provado, que equivalentes químicos dessas substâncias naturais poderiam nos ajudar a esquecer o passado quando os sinais que aprendemos a associar a certos perigos tivessem deixado de fazer sentido. Maconha sintética Ainda que seu repertório de efeitos não esteja totalmente claro, o conhecimento gerado sobre os endocanabinóides começa a ajudar pesquisadores a conceber terapias que aproveitem as propriedades terapêuticas da maconha. Em alguns países, por exemplo o Canadá, vários análogos sintéticos do THC já estão disponíveis comercialmente, como a nabilona e o dronabinol. Ambos combatem a náusea causada pela quimioterapia; o dronabinol também estimula o apetite em pacientes com aids. Outros canabinóides aliviam a dor provocada por uma infinidade de doenças. Além disso, um antagonista do CB1 - molécula que bloqueia o receptor e o torna inativo - funcionou em alguns testes clínicos para o tratamento de obesidade. Embora promissoras, todas essas drogas têm efeitos múltiplos porque não são específicas. Ao contrário, agem em toda parte, causando reações adversas como tontura, sonolência, dificuldade de concentração e distúrbios cognitivos. Uma forma de contornar tais problemas é realçar o papel desses mensageiros no próprio organismo. Se a estratégia for bem-sucedida, os endocanabinóides poderão ser recrutados apenas em circunstâncias e locais necessários, sem os riscos associados à ativação geral e indiscriminada de seus receptores. Com esse objetivo, Daniele Piomelli e colegas estão desenvolvendo drogas que impedem que a anandamida seja degradada, prolongando seus efeitos no alívio da ansiedade. Em algumas regiões do sistema nervoso a anandamida parece ser o endocanabinóide mais abundante; em outras predomina o 2-AG. Compreender melhor as vias químicas que sintetizam cada um deles deverá ajudar no desenvolvimento de drogas que afetem seletivamente um ou outro receptor. Além disso, já se sabe que endocanabinóides não são produzidos quando os neurônios disparam apenas uma vez, mas somente após uma rajada de cinco até dez disparos. Uma possibilidade, portanto, seria a criação de fármacos que modificassem a taxa de disparo e, logo, a liberação do endocanabinóide. Essa idéia já tem precedente: os agentes anticonvulsivantes, que suprimem a hiperatividade neuronal subjacente às crises epiléticas sem afetar outras regiões com atividade normal. Abordagens indiretas poderiam ter como alvo processos que regulam os endocanabinóides. A dopamina, neurotransmissor deficiente nas pessoas com doença de Parkinson, também é fundamental nos sistemas de prazer. Drogas como a nicotina e a morfina produzem seus efeitos, em parte, estimulando sua liberação em diversas regiões. Entretanto, a dopamina estimula a liberação dos endocanabinóides, e diversos pesquisadores identificaram dois outros neurotransmissores - glutamato e acetilcolina - que fazem o mesmo. De fato, os endocanabinóides podem ser a fonte de uma série de efeitos antes atribuídos a outras moléculas. Em vez de mirar diretamente o sistema endocanabinóide, poderiam ser criadas drogas com ação sobre esses mensageiros convencionais. Diferenças regionais em sistemas neurotransmissores devem ser exploradas para assegurar que os endocanabinóides sejam liberados somente onde são necessários e em quantidades apropriadas. De maneira notável, os efeitos da maconha revelaram os endocanabinóides ao mundo. O receptor CB1 parece estar presente em todos os vertebrados, o que sugere que sistemas canabinóides endógenos existem há cerca de 500 milhões de anos. Durante esse tempo eles se adaptaram para desempenhar numerosas funções, ainda que freqüentemente sutis. Aprendemos que eles não afetam o medo, mas o esquecimento dele; não alteram a capacidade de comer, mas o apetite por alimento, e assim por diante. Sua presença em regiões associadas ao comportamento motor complexo, à cognição, à aprendizagem e à memória sugere que muita coisa resta a descobrir sobre os usos que a evolução fez dessas moléculas.
* Roger A. Nicoll é professor de farmacologia da Universidade da Califórnia
em São Francisco. Bradley E. Alger leciona fisiologia e psiquiatria na
Faculdade de Medicina da Universidade de Maryland. Desde a década de 70
ambos desenvolvem pesquisas sobre transmissão sináptica. - Tradução de
Sérgio Blum.
Fonte: Mente&Cérebro, ed. n. 165, out/2006. |
||||||||||